The demand for fish has increased significantly in recent years due to consumers' desire for healthier food. The market has responded by producing a wide variety of fresh and processed fish products. As a result, the fraudulent substitution of lower-grade fish for higher-grade fish has become an enormous issue in the fishing industry.
(Référence 1).
The substitution of lower-value commercial fish can be voluntary or the result of mistaken substitution, as the species look very similar to each other. Verifying the quality of fish and seafood products and ensuring that the information on the label is accurate (as to quality and origin) is very important.
NIR spectroscopy is the most versatile method for this type of testing because of its sensitivity to organic molecules, ease of use, and cost-effectiveness. Recent technological developments in spectroscopic instrumentation and the availability of miniaturized, handheld spectrometers on the market will help with this identity verification task in the food sector. It should also be noted that there are other competing techniques, such as Nuclear Magnetic Resonance (NMR) (Reference 1), Hyperspectral imaging (Reference 1,2), and fluorescence spectroscopy (Reference 1), that can detect fraud in the fishing industry. Sometimes, these techniques can be used in collaboration with one another. However, the article focuses on the role of near-IR spectroscopy for this task. Analytical approaches such as chemometrics play a vital role in falsification detection because they can identify similarities and differences in spectra that can be used to distinguish fraudulent substitutions in the fish industry.
En ce qui concerne les problèmes d’authenticité dans l’industrie du poisson, quatre catégories peuvent être nommées (référence 1) qui sont
• Substitution d'espèces
• Fausse représentation de la méthode de production et du système agricole
• Falsification de l'origine géographique
• Substitution de produits frais pour produits congelés/décongelés
This article discusses fraudulent activities and their detection using NIR spectroscopy. Monitoring of fish products for these fraudulent activities is impeded by the growing prevalence of highly processed products, for which fraud can be easily concealed. There are also external factors that can be used to identify fish in each category. For example, higher levels of heavy metals or residues of antibiotics and pesticides are more likely to be found in farmed products than in wild products. The article will next examine each fraudulent activity.
Substitution d'espèces
Substituting higher-quality fish for lower-quality or counterfeit fish is a common problem that is growing by the day. A scientific in-situ test that could quickly confirm the contents of the fish as mentioned on the label is highly in demand. Figure 1 shows a depiction of species substitution.

Figure 1 : Substitution frauduleuse de poisson
As an example of the use of NIR for identifying fraudulent fish substitution, one can cite research on discriminating between two species of low-value and high-value mullet, cod, and trout. The research used a Near-IR spectrometer (906-1048 nm) to measure the whole body and fillet of each species, and chemometric analysis, such as PCA and SIMCA, was performed to distinguish between them (Reference 3). Both methods are classified under multivariate analysis. It was found that although PCA could distinguish between low- and high-quality whole mullet, it failed in all other categories. However, SIMCA successfully distinguished between low- and high-quality mullet, cod, and trout in both whole fish and fillet forms. The usefulness of near-IR spectroscopy was also explored in the identification of different species of fish used to make fish meal under industrial conditions (Reference 4). Fishmeal is generally used in products intended for animal feed and not for human consumption. Near-IR measurements in the range 1100-2500 nm were performed for salmon, blue whiting, and mackerel. The second derivatives of the spectra were subjected to PCA and PLS-DA chemometric methods, and the three species were differentiated with classification accuracies greater than 80%.
Méthode de production et substitution du système agricole
La figure 2 montre un saumon frais et un saumon d'élevage et la différence d'apparence entre les deux
 Figure 2 : Différence entre le saumon frais et le saumon d'élevage
Figure 2 : Différence entre le saumon frais et le saumon d'élevage
Over the last few years, the production of farmed-raised fish has been steadily increasing compared to wild fish supplies. There are differences in the nutritional values of the two. Wild fish contain higher levels of muscle protein and also higher levels of saturated and polyunsaturated fatty acids. However, farmed fish contain more monounsaturated fatty acids and lipids. The colors are different, too, as depicted in Figure 2. Farmed salmon has a paler pink color compared to reddish wild salmon. As an example of the use of NIR spectroscopy to distinguish between farmed and wild fish, correct classification was performed using near IR measurements and a PLS-DA chemometrics method to differentiate between concrete tank sea cultured seabass and sea-cage cultured seabass with an 87% rate of success (Reference 5).
Falsification de la méthode géographique
La figure 3 est une représentation de l’origine géographique du saumon provenant de différentes zones géographiques.
Figure 3 : L'origine géographique de tout type de poisson tel que le saumon pourrait être différente (Référence 6)
Proving the geographical origin of a particular type of fish is quite tricky because modelling the total variability of NIR spectra and attributing it to geographic origin involves a sum of many intrinsic or extrinsic factors, such as genetic, growth patterns, muscular activity, water temperature, etc. (Reference 1). Spectroscopie NIRCette distinction est moins fréquemment effectuée et des méthodes multidisciplinaires sont généralement utilisées à cette fin. Ces méthodes prennent en compte les facteurs environnementaux et les informations génétiques qui influencent les caractéristiques finales du poisson.
Français À titre d'exemple d'utilisation de la spectroscopie NIR pour trouver l'origine géographique, on peut se référer à une étude dans laquelle des filets de tilapia chinois provenant de 3 provinces différentes de Chine (Guangdong, Hainan et Fujian) ont été étudiés à l'aide de la spectroscopie NIR (référence 7). Dans l'étude, les spectres proche IR du poisson ont été collectés dans la gamme 1000-2500 nm et une méthode chimiométrique appelée SIMCA a été utilisée avec un taux de réussite de 80 % pour distinguer les différentes origines géographiques. À titre d'autre exemple, des bars européens provenant des provenances de la Méditerranée occidentale, centrale et orientale ont été étudiés par spectroscopie NEAR-IR et une méthode chimiométrique PLS-DA a réussi à classer correctement 100 % des provenances orientales, 88 % centrales et 85 % occidentales (référence 8). La figure 4 montre un spectre prétraité typique d'échantillons de bar et un regroupement basé sur un graphique de score après avoir effectué une analyse PCA où CM, EM et WM font référence à la Méditerranée centrale, orientale et occidentale.
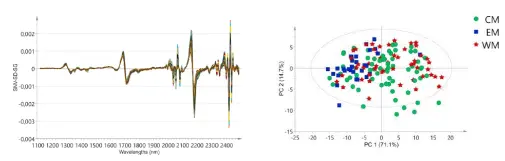
Figure 4 : Spectres prétraités du bar et regroupement des scores en fonction de la situation géographique (référence 8)
Discrimination entre les fruits de mer frais et congelés/décongelés
Figure 5 compares fresh and frozen salmon.
 Figure 5 : Saumon frais et congelé
Figure 5 : Saumon frais et congelé
Fish is usually frozen to preserve it for longer periods. However, the quality of frozen fish is much lower than fresh fish. That’s why fraudulent practices often try to substitute frozen or thawed fish for fresh fish. When a fish is frozen, some chemical and physical variations are imperceptible by sensory organs, and NIR spectroscopy is one way to detect these tiny changes. As an example of the use of NIR spectroscopy to differentiate between fresh and frozen/thawed fish, one can refer to a study in which swordfish was assessed for freshness or frozen/thawed quality using NIR spectra in the range 1100-2500 nm (Reference 9). After applying the chemometric method PLS-DA, 93% successful classification was achieved.
Imagerie hyperspectrale
Hyperspectral imaging uses cameras with a large number of pixels and obtains a spectral image for each pixel in the image of a scene that can also bebe used to detect falsification of fish. In one study involving fresh and frozen/thawed halibut, hyperspectral cameras were used in the range 380-1030 nm and after applying a chemometric method, a classification success rate of nearly 92% was obtained (Reference 10).
Spectromètre NIR d'Allied Scientific Pro
Allied Scientific Pro offers the Nirvascan spectrometer, which uses Texas Instruments Digital Light Processing (DLP) technology. There are two available ranges: 900-1700 nm and 1350-2150 nm. The spectrometer suitable for fish impurity detection is a reflective, portable model. The NIR spectrum can be recorded in a few seconds by the press of a button. The following link has more information about this spectrometer.
https://www.alliedscientificpro.com/nirvascan
Références :
1-Approche des problèmes d'authenticité des produits de la mer par spectroscopie qualitative et chimiométrique, S. Ghidini et.al, Molecules, 2019, 24, 1812
2-Évaluation de la qualité des poissons par imagerie hyperspectrale, chapitre 8 de Imagerie hyperspectrale pour l'analyse et le contrôle de la qualité des aliments, édité par Da-Wen Sun, décembre 2010.
3-Authentification spectroscopique proche infrarouge des fruits de mer, N.O’Brien et.al, Journal of near infrared spectroscopy, 2013, 21.
4-Utilité de la spectroscopie de réflectance proche infrarouge (NIR) et de la chimiométrie, pour discriminer les lots de farine de poisson fabriqués avec différentes espèces de poissons, D. Cozzolino et.al, Journal of Agric .Food. Chem, 2005, 53.
5-Application de techniques non invasives pour différencier la qualité du bar cultivé dans différentes conditions, C. Costa et.al, Aquac. Int. 2011, 19.
6-https://fishingbooker.com/blog/types-of-salmon/
7-Prédiction de la composition chimique et de la traçabilité de l'origine géographique des produits de filets de tilapia d'exportation chinois par spectroscopie de réflectance proche infrarouge, Y. Liu et.al, LWT-food Sci.Technology, 2015, 60.
8-Authentification rapide du bar européen selon le mode de production, le système d'élevage et l'origine géographique par spectroscopie proche infrarouge couplée à la chimiométrie, S.Ghidini et.al, Food Chem, 2019, 280.
9-Comparaison de la spectroscopie de réflectance visible et proche infrarouge pour authentifier l'espadon frais et congelé-décongelé, L.Fasolato et.al, J.Aquat. Food. Prod,. Technol. 2012, 21.
10-Application de l'imagerie hyperspectrale visible et proche infrarouge pour différencier les filets de poisson frais et congelés-décongelés, F.Zhu et.al, Food Bioprocess Technol, 2013,6.